前立腺癌に対するホルモン療法
NCIファクトシート 原文日付:2013年12月12日
更新 2019年2月28日
男性ホルモンとはどのようなものでしょうか?
ホルモンは、体内の腺によって産生され、化学シグナルとして作用する物質です。しばしば血流を介して体内をめぐり、さまざまな場所の細胞や組織にたどりついて、その活動に作用します。
アンドロゲン(男性ホルモン)は、男性性徴の発現・維持を制御するホルモンです。テストステロンとジヒドロテストステロン(DHT)は、男性で最も多いアンドロゲンです。ほとんどのテストステロンは精巣で産生されますが、少量が副腎で産生されます。また一部の前立腺がん細胞はコレステロールからのテストステロン産生能を獲得します。(1)
ホルモンはどのようにして前立腺がんの増殖を促しますか?
アンドロゲンは、精液の産生を促す男性生殖器系の腺である前立腺の正常な成長と機能に欠かせないものです。アンドロゲンはまた、前立腺がんの増殖にも欠かせません。アンドロゲンは前立腺細胞内で発現しているタンパク質(2)であるアンドロゲン受容体に結合し活性化させることで、前立腺の正常細胞とがん細胞両方の増殖を促します。アンドロゲン受容体は活性化されると、前立腺細胞の増殖を引き起こす特定の遺伝子の発現を促します(3)。
前立腺がんの発生早期では、比較的高濃度のアンドロゲンが増殖に必要です。このような前立腺がんは、アンドロゲン濃度を低下させる治療やアンドロゲン活性を阻害する治療によってその増殖が抑制されることから、去勢感受性、アンドロゲン依存性またはアンドロゲン感受性と言われます。
アンドロゲンを阻害する薬剤や外科手術で治療された前立腺がんは最終的には「去勢抵抗性」になります。それは、体内のアンドロゲン濃度が極度に低いか検出されないレベルであっても、前立腺がんが増殖し続けることを意味します。かつて、こうしたホルモン抵抗性、アンドロゲン非依存性、またはホルモン不応性とも言われましたが、こうした言葉は現在ほとんど使用されません。その理由は、去勢抵抗性がんが1種類以上の新規の抗アンドロゲン薬に反応するためです。
どのような種類のホルモン療法が前立腺がん治療に使用されますか?
前立腺がんに対するホルモン療法は、アンドロゲンの産生やその作用を抑制することができます(4)。現在使用されている治療法は、以下に示すように幾通りかの機序でそれを達成します。
- 精巣でのアンドロゲン産生の抑制。
- 体内でのアンドロゲンの作用の阻害。
- 体内でのアンドロゲン産生(合成)の阻害。
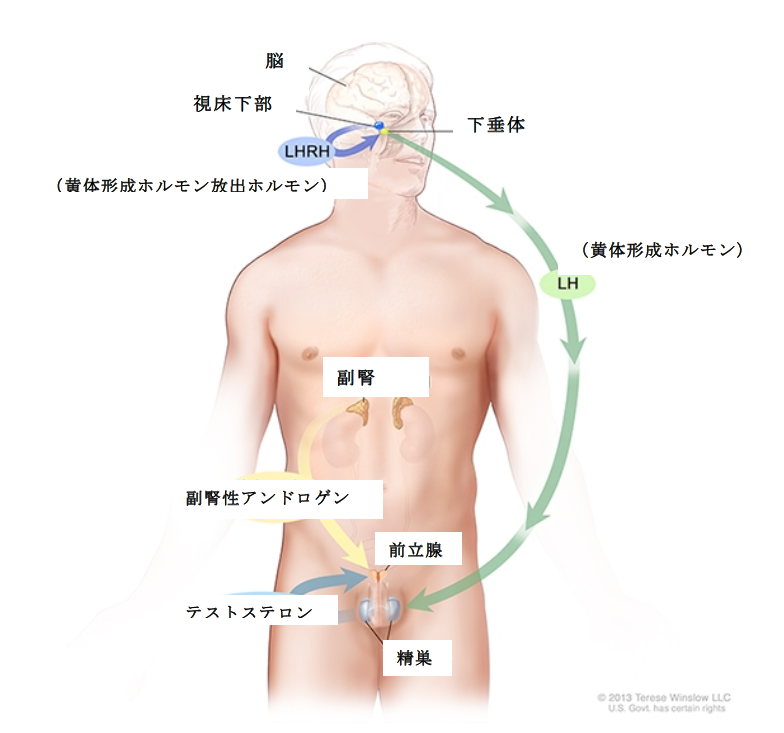
図.男性におけるアンドロゲン産生。テストステロン産生は、黄体形成ホルモン(luteinizing hormone;LH)と黄体形成ホルモン放出ホルモン(luteinizing hormone-releasing hormone;LHRH)により調節されていることを示しています。視床下部はLHRHを分泌し、LHRHは下垂体からのLHの分泌を促します。LHは精巣内の特定の細胞に作用し、体内のテストステロンのほとんどの産生を促します。その他のアンドロゲンのほとんどは、副腎により産生されます。アンドロゲンは前立腺細胞により取り込まれ、そこで直接アンドロゲン受容体に結合するか、テストステロンよりも強いアンドロゲン受容体への親和性をもつジヒドロテストステロン(dihydrotestosterone;DHT)に変換されます。
精巣でのアンドロゲン産生を抑制する治療法は、前立腺がんに対して最も一般的に使用されるホルモン療法、かつ、前立腺がん男性患者の大多数が受ける最初のホルモン療法です。こうしたホルモン療法(アンドロゲン遮断療法(androgen deprivation therapy;ADT)とも言われます)は以下に示す通りです。
- 精巣摘除術:精巣を1つあるいは両方摘出する外科手術。 両方の精巣を摘出することで、 血中テストステロン濃度を90%~95%減少させることができます(5)。この治療法は外科的去勢術と言われますが、永続的で不可逆的です。被膜下精巣摘除術と言われる精巣摘除術では、精巣全体ではなく、アンドロゲンを産生する精巣内の組織のみを摘出します。
- 黄体形成ホルモン放出ホルモン(LHRH)アゴニスト:黄体形成ホルモンの分泌を抑制。LHRHアゴニストはLHRHアナログと言われることもありますが、LHRHと構造が類似している合成タンパク質で、下垂体内のLHRH受容体に結合します。(LHRHはゴナドトロピン放出ホルモン(gonadotropin-releasing hormone;GnRH)としても知られているので、LHRHアゴニストはGnRHアゴニストとも言われます。)
通常、体内のアンドロゲン濃度が低いときは、LHRHが下垂体を刺激して黄体形成ホルモン産生を促し、次に黄体形成ホルモンが精巣によるアンドロゲン産生を促します。LHRHアゴニストは、体内のLHRHと同様に、最初は黄体形成ホルモン産生を促しますが、そのLHRHアゴニストの高レベル状態が続くと、実際には下垂体の黄体形成ホルモン産生が停止することになります。その結果、精巣はアンドロゲン産生を促進する刺激を受けなくなります。
LHRHアゴニストによる治療は、外科的去勢術(精巣摘除術)と同程度のことができる薬剤が使用されるため、内科的去勢術 や化学的去勢術と言われます。しかし、精巣摘除術と異なり、アンドロゲン産生に対するこれらの薬剤の効果は可逆的です。治療が中断されると、アンドロゲン産生は通常回復します。
LHRHアゴニストは皮下に注射あるいは皮下に埋め込まれます。リュープロリド、ゴセレリン、トリプトレリンおよびヒストレリンの4剤が米国で前立腺がんの治療薬として承認されています。
前立腺がん患者が初めてLHRHアゴニストを投与される際、「テストステロン・フレア現象」と言われる症状が生じることがあります。このようにテストステロン濃度が一時的に上昇するのは、LHRHアゴニストにより下垂体による黄体形成ホルモンの分泌が抑制される前に、一時的に亢進させるためです。フレア現象により、臨床症状(例.骨痛、尿管や膀胱出口の閉塞、脊髄圧迫)が悪化することがあり、進行前立腺がん患者にとっては特に問題となることがあります。このテストステロン濃度上昇は通常、治療最初の数週間にLHRHアゴニスト投与と共に抗アンドロゲン療法(以下を参照)という別種のホルモン療法を行うことで対処されます。
- LHRHアンタゴニスト:別種の内科的去勢術。LHRHアンタゴニスト(GnRHアンタゴニストとも称される)は、LHRHが下垂体内のLHRH受容体と結合するのを阻害します。次に下垂体による黄体形成ホルモンの分泌を抑制し、、精巣によるアンドロゲン産生を抑制します。LHRHアンタゴニストはLHRHアゴニストと異なり、テストステロン・フレアを引き起こしません。
唯一のLHRHアンタゴニストであるデガレリクスは現在、米国で進行前立腺がんの治療薬として承認されています。なお、デガレリクスは注射剤です。
体内のアンドロゲンの作用を抑制する薬剤(抗アンドロゲン療法とも言います)は通常、ADTが有効でなくなったときに、使用されます。こうした治療薬には以下のようなものがあります。
アンドロゲン受容体阻害薬(アンドロゲン受容体アンタゴニストとも言われます):アンドロゲン受容体との結合の際に、アンドロゲンと拮抗する薬剤。アンドロゲン受容体阻害薬は、アンドロゲン受容体との結合の際にアンドロゲンと拮抗して、前立腺がんの増殖を促すアンドロゲンの作用を抑制します。
アンドロゲン受容体阻害薬はアンドロゲン産生を阻害しないため、前立腺がん治療において単剤投与は稀ですが、ADT(精巣摘除術またはLHRHアゴニスト)と併用されます。精巣摘除術や LHRHアゴニストと併用する抗アンドロゲン薬療法は、複合アンドロゲン遮断療法、完全アンドロゲン遮断療法、または完全アンドロゲン遮断療法と言われます。
米国で前立腺癌治療薬として承認されている抗アンドロゲン薬には、フルタミド、エンザルタミド、アパルタミド、ビカルタミド、およびニルタミドがあります。いずれも経口錠剤です。
体内のアンドロゲン産生を抑制する薬剤は以下のとおりです。
アンドロゲン合成阻害薬:副腎、前立腺がん細胞自身、および精巣でのアンドロゲン産生を抑制する薬剤。内科的去勢術も外科的去勢術も副腎や前立腺癌細胞によるアンドロゲン産生を抑制しません。副腎や前立腺がん細胞が産生するアンドロゲンの量は、少量ですが、一部の前立腺がんの増殖を支えるには十分な量です。
アンドロゲン合成阻害薬は他の治療法と比べて大幅に体内のテストステロン濃度を低下させることができます。これらの薬剤はCYP17と言う酵素を阻害することでテストステロン産生を抑制します。CYP17は精巣、副腎、および前立腺がんの組織内に存在し、人体によるコレステロールからのテストステロン産生に欠かせません。
アビラテロン酢酸エステル、ケトコナゾール、およびアミノグルテチミドのアンドロゲン合成阻害薬3剤が米国で承認されており、いずれも経口錠剤です。
アビラテロン酢酸エステルはプレドニゾンとの併用で転移性高リスク去勢感受性前立腺がんの治療薬として、また、転移性去勢抵抗性前立腺がんの治療薬として承認されています。アビラテロン酢酸エステルとエンザルタミドの承認以前は、前立腺がん以外の適応症に対して承認されている2種の薬剤であるケトコナゾールとアミノグルテチミドは去勢抵抗性前立腺がんに対する二次治療として適応外使用されることがありました。
ホルモン療法は、どのように前立腺がんの治療に使用されますか?
ホルモン療法は以下に示す方法で、前立腺がんの治療に使用されることがあります。
- 中程度または高い再発リスクがある早期前立腺がん。中程度または高い再発リスクがある早期前立腺がん患者はしばしば、放射線治療の前、最中、およびもしくはまたは後にホルモン療法を受けます。または、前立腺全摘除術(前立腺を切除する手術)の後にホルモン療法を受けることがあります(6)。前立腺がん再発リスクの判断に使用される要因には、腫瘍のグレード(グリソン・スコアにより評価)、腫瘍が周囲の組織に浸潤した程度、および手術中における周辺リンパ節内の腫瘍細胞の存在の有無などがあります。
早期前立腺がんに対するホルモン療法を使用する治療の期間は、患者の再発リスクによって変わります。ホルモン療法は、中リスク前立腺がん患者では一般に6カ月間実施されます。一方、高リスク患者では一般に18~24カ月間実施されます。
前立腺摘除術の後にホルモン療法を受けた患者では、前立腺全摘除術のみを受けた患者と比べて、無再発生存期間は延長しますが、全生存期間は延長しません(6)。中または高リスク前立腺がんに対する体外照射の後にホルモン療法を受けた患者では、体外照射のみを受けた患者と比べて、全生存期間と無再発生存期間の両者が延長します(6,7)。 ホルモン療法と放射線治療を併用して受けた患者でも、放射線治療のみを受けた患者と比べて、全生存期間は延長します(8)。とはいえ、放射線治療前後のADTにおける最適な時期と期間は確立されていません(9,10)。
前立腺全摘除術の前に(単独または化学療法と併用で)施行されるホルモン療法は生存期間の延長が示されず、標準的治療法ではありません。前立腺全摘除術前に、さらに強化したアンドロゲン遮断療法が臨床試験で検討されているところです。
- 再発前立腺がん。放射線治療や前立腺全摘除術による治療の後に前立腺がんの再発がCT、MRI、または骨シンチグラフィーにより示された患者に対しては、ホルモン単独療法が標準的治療法になります。ホルモン療法は、「生化学的」再発—外科手術や放射線治療による一次局所治療後に前立腺特異抗原(prostate-specific antigen;PSA)濃度の上昇—が認められる患者、特に3カ月以内にPSA濃度が倍加し、がんが未転移の患者に対して推奨されることもあります。
前立腺全摘除術後に生化学的再発した患者を対象にしたランダム化臨床試験から、抗アンドロゲン療法+放射線治療を受けた患者はプラセボ+放射線治療を受けた患者と比べて、前立腺がんの転移や、前立腺がん死亡、全死亡の可能性が低くなることが分かりました(11)。 しかし、PSA値が低い患者に対して放射線治療へのホルモン療法の追加は有効ではありませんでした。他の最近実施された臨床試験から、一次局所治療後にPSA値が上昇し、また、転移リスクが高いとはいえ、前立腺がん転移の所見が無い患者にとって、ドセタキセルによる化学療法をADTに追加することは生存期間の各種評価に関してADT単独よりも優越性を示さないことが分かりました(12)。
- 進行または転移性前立腺がん。前立腺がんと初めて診断された時に転移性がん(体の他の部位に転移したがん)であった患者に対しては、ホルモン単独療法が標準的治療法になります(13)。臨床試験から、こうした患者で、ADT+アビラテロン酢酸エステル/プレドニゾン、エンザルタミド、もしくはアパルタミド療法がADT単独療法と比べて、生存期間が延長することが示されています(14~17)。しかし、ホルモン療法には相応の副作用が生じる可能性があるため、症状が出現する前にホルモン療法を受けないことを望む患者もいます。
2つのがん研究共同グループ―米国東部協同腫瘍学グループ(ECOG)と米国放射線学会画像診断ネットワーク(the American College of Radiology Imaging Network;ACRIN)―が実施した米国国立がん研究所(NCI)助成の臨床試験の初期報告により、標準ホルモン療法開始時に化学療法剤ドセタキセル投与を受けたホルモン感受性転移前立腺がん患者は、ホルモン療法のみを受けた患者と比べて、全生存期間が延長したことが示唆されました。転移範囲が最大の患者はドセタキセルの早期追加投与により最大の利益を得たようです。こうした結果は最近長期追跡調査で確認されました(18)。
- 症状緩和。ホルモン療法は、手術や放射線治療の対象でない限局性前立腺がん患者における局所症状の緩和や予防の目的で、単独で使用されることもあります(19)。このような前立腺がん患者には、期待余命が短い患者、局所進行腫瘍を有する患者、他の重篤な健康状態の患者などがいます。。
ホルモン療法の効果をどのようにして知ることになりますか?
医師は、ホルモン療法がどのくらいの期間、各患者の前立腺がん増殖を抑制する効果があるかを予測することはできません。それゆえ、2~3カ月以上ホルモン療法を受けている患者は定期的に血中PSA 濃度の検査を受けることになります。 PSA濃度上昇は、患者の癌の再増殖が始まったことを示す可能性があります。ホルモン療法が奏効して非常に低いアンドロゲン濃度を維持しているにもかかわらずPSA濃度が上昇し続けていることは、患者の前立腺癌が現在使用されているホルモン療法に対して抵抗性を示しているということを示しています。
去勢抵抗性前立腺がんはどのようなものですか?
最初はADT(LHRHアゴニスト、LHRHアンタゴニスト、または精巣摘除術によるホルモン療法)に反応する前立腺がんの多くは、最終的にはADTに反応しなくなります。こうしたがんは去勢抵抗性前立腺がんと言われます。去勢抵抗性前立腺がんは去勢感受性前立腺がんと比べて、アンドロゲン濃度が非常に低くても増殖できます。
いくつかの機序により、アンドロゲン濃度が非常に低い場合でも前立腺がん細胞が増殖できるようになる可能性があります。具体的には、腫瘍細胞内のアンドロゲン受容体分子産生量の増加(これは、アンドロゲン受容体遺伝子発現量の増加または細胞1個当たりのアンドロゲン受容体遺伝子のコピー数の増加を介する)、より高活性の受容体タンパク質を作るアンドロゲン受容体遺伝子の変化、アンドロゲン受容体の機能制御に働くタンパク質の活性の変化、およびアンドロゲン受容体が関与しない機序によるがん増殖などです(20~22)。
去勢抵抗性前立腺がんに対する治療選択肢はどのようなものでしょうか?
- 完全アンドロゲン遮断療法:アンドロゲン受容体阻害薬(フルタミド、ビカルタミド、ニルタミド、アパルタミド、またはエンザルタミド+ADT
- アビラテロン酢酸エステルによるアンドロゲン合成阻害+ADT
- 細胞を用いたワクチンであるシプロイセルTを使用する免疫療法:このワクチンは、ほとんど症状を示さないもしくは無症候性かつホルモン療法抵抗性の転移前立腺がんに対抗するために患者由来の免疫細胞を使用します。
- 化学療法:通常、抗がん剤ドセタキセルが使用されます。もう1つの抗がん剤カバジタキセルは、ドセタキセル治療歴のある転移性去勢抵抗性前立腺がん治療薬として承認されています。
- 塩化ラジウム223:骨転移を有し症状を引き起こしているが、その他の臓器転移のない去勢抵抗性前立腺がん患者の治療薬として承認されている放射性医薬品。塩化ラジウム223は骨転移が生じている部位などの代謝速度が増加している骨の部位に集積し、放射線を放出してがん細胞を殺傷します。
これらの治療を受ける去勢抵抗性前立腺がん患者はテストステロン濃度上昇(一部の患者では腫瘍進行を引き起こすことがある)を予防するために、ADT(例.LHRH アゴニスト)を受け続けることになります(23)。
ランダム化臨床試験から、化学療法歴の有無を問わず、アビラテロン酢酸エステルやエンザルタミド療法が転移性去勢抵抗性前立腺がん患者の生存期間を延長することが示されています(16,17,24, 25)。SPARTAN試験から、アパルタミドが非転移性去勢抵抗性前立腺がん患者で無転移生存期間(患者ががん転移や死亡することなく生存できる治療中や治療後の期間)を延長することが示されました(26)。同様に、PROSPER試験から、エンザルタミドがこうした患者で無転移生存期間を延長することが示されました(27)。
ARAMIS試験の中間解析から、ADT+ダロルタミド(治験対象アンドロゲン受容体阻害薬)はADT+プラセボと比較して、非転移性去勢抵抗性前立腺がん患者の無転移生存期間を延長したことが示唆されました(28)。アパルタミドやエンザルタミドと異なり、ダロルタミドは血液脳関門を通過せず、中枢神経系副作用がより少ない可能性があります。
間欠的ADTはどのようなものですか?
研究者らは、間欠的ADTと言われる治療法が前立腺がんに対するホルモン療法の効果を改善できるか、即ち、ホルモン抵抗性の発生を遅延できるかを研究しています。間欠的ADTでは、ホルモン療法用薬剤は投与期間の間に休薬期間が設けられ、連続投与されずに周期的に投与されます。間欠的ADTの更なる利益の可能性は、ホルモン療法の副作用から一時的に回復することで患者の生活の質が改善する可能性があることです。
局所治療後にPSA濃度が上昇した患者における間欠的ADTを連続的ADTと比較するランダム化臨床試験から、間欠的ADTは全生存期間に関して連続的ADTと比較して「非劣性」で、副作用が少ないことが分かりました(29)。一方、転移性ホルモン感受性前立腺がん患者における間欠的ADTを連続的ADTと比較するランダム化臨床試験は、間欠的ADTで死亡リスクが 20%上昇することを排除できませんでした(即ち、間欠的ADTは「非劣性」ではありませんでした)(30)。転移または再発前立腺がん患者における間欠的ADTを連続的ADTと比較する臨床試験のメタ解析から、全体的に見て、間欠的ADTは一部の身体や性的機能への副作用を改善し、全生存期間に関して連続的ADTと比較して非劣性であることが分かりました(31)。
前立腺がんに対するホルモン療法の副作用はどのようなものでしょうか?
アンドロゲンは前立腺以外の他の多くの臓器により使われますので、ADTにより以下の様々な副作用が生じる可能性があります(4,32)。
抗アンドロゲン薬は、下痢、乳房痛、悪心、ほてり、性欲減退、および勃起不全を引き起こす可能性があります。抗アンドロゲン薬フルタミドは肝障害を引き起こすことがあり、エンザルタミドとアパルタミドは痙攣発作、転倒、および骨折を引き起こすことがあります。
アンドロゲン合成阻害薬は下痢、掻痒、発疹、疲労、(長期使用による)勃起不全、および潜在的に肝障害を引き起こす可能性があります。
エストロゲンにより他の種類のホルモン療法で認められる骨密度低下は回避されますが、心臓発作や脳卒中などの心血管系副作用リスクが増加します。エストロゲンはこれらの副作用により、現在ではほとんど前立腺がんに対するホルモン療法に使用されません。
放射線治療の後にアジュバントホルモン療法を受けることで、放射線治療の有害反応の一部、特に性機能と体力への副作用が強まります(33)。前立腺がん患者がホルモン療法を受ける期間が長くなるほど、その副作用の多くもまた強まります(32)。
どのようにすれば、前立腺がんに対するホルモン療法の副作用を軽減できるでしょうか?
長期にわたるホルモン療法により骨量が減少する患者は、骨量減少を遅らせるまたは骨量を回復させる薬剤が処方されることがあります。ゾレドロン酸またはアレンドロン酸(これらはビスホスホネート製剤と称される薬剤に属する)は、ホルモン療法を受けている患者の骨密度の増加に使用されます(34,35)。一方、新薬デノスマブは異なる機序で骨量を増加させます(36)。しかし、、前立腺癌に対するホルモン療法を受けている患者の治療薬として2011年に承認されています。しかし、骨量減少に対する治療薬は、稀とはいえ重篤な副作用である顎骨壊死を引き起こすことがあります(23)。
運動により、骨量減少、筋肉量の減少、体重増加、疲労、およびインスリン抵抗性などのホルモン療法の副作用の一部が軽減することがあります(23,37)。いくつかの臨床試験で、運動が前立腺がんに対するホルモン療法の副作用からの回復や副作用の予防ができるか否かが研究されています。
前立腺がんのホルモン療法による、性機能に関わる副作用は対処が最も困難なものの1つです。シルデナフィル(バイアグラ®)などの勃起不全治療薬は、アンドロゲンの欠乏と関連する性欲減退に作用しないため、通常ホルモン療法を受けている患者に対して有効ではありません。
がん治療における性的機能への副作用に関する詳細は、ファクトシート「Sexuality and Reproductive Issues(日本語訳:外部リンク 性的能力(セクシャリティー)および生殖の問題(PDQ®))をご覧下さい。
ほとんどの患者は可逆的なホルモン療法を中断すると、アンドロゲン濃度の低下が引き起こす性的機能や情緒面への副作用は最終的には消失します。しかし、何年にもわたってホルモン療法を受けていると、これらの副作用は完全に消失しないことがあります。ホルモン療法の中断後でも、骨量減少などの時間と共に生じた一部の身体的変化は、残存することがあります。
患者は市販のハーブ系薬剤などを含め、どんな薬剤を服用するときも必ず、担当医に確実に伝えてください。一部のハーブ系薬剤は体内の薬物代謝酵素との相互作用を起こし、ホルモン療法に対して有害な影響を与える可能性があります(38)。
前立腺がんに対するホルモン療法の臨床試験の検索の支援
前立腺がんに対するホルモン療法の臨床試験に関する情報を知るために、NCIがん情報サービス(電話番号:1-800-4-CANCER、1-800-422-6237)に連絡してください。
主要参考文献
- Dillard PR, Lin MF, Khan SA. Androgen-independent prostate cancer cells acquire the complete steroidogenic potential of synthesizing testosterone from cholesterol.Molecular and Cellular Endocrinology 2008; 295(1-2):115-120. [PubMed Abstract]
- Massie CE, Lynch A, Ramos-Montoya A, et al. The androgen receptor fuels prostate cancer by regulating central metabolism and biosynthesis. EMBO Journal 2011; 30(13):2719-2733.[PubMed Abstract]
- Hååg P, Bektic J, Bartsch G, Klocker H, Eder IE. Androgen receptor down regulation by small interference RNA induces cell growth inhibition in androgen sensitive as well as in androgen independent prostate cancer cells. Journal of Steroid Biochemistry and Molecular Biology 2005; 96(3-4):251-258.[PubMed Abstract]
- Lee RJ, Smith MR. Hormone Therapy for Prostate Cancer. In: Chabner BA, Longo DL, eds.Cancer Chemotherapy and Biotherapy: Principles and Practice. 5th ed: Wolters Kluwer: Lippincott Williams & Wilkins; 2011.
- Rove KO, Crawford ED. Androgen annihilation as a new therapeutic paradigm in advanced prostate cancer. Current Opinion in Urology 2013; 23(3):208-213.[PubMed Abstract]
- Kumar S, Shelley M, Harrison C, et al. Neo-adjuvant and adjuvant hormone therapy for localised and locally advanced prostate cancer. Cochrane Database of Systematic Reviews 2006(4): CD006019.[PubMed Abstract]
- Bolla M, Van Tienhoven G, Warde P, et al. External irradiation with or without long-term androgen suppression for prostate cancer with high metastatic risk: 10-year results of an EORTC randomised study. Lancet Oncology 2010; 11(11):1066-1073.[PubMed Abstract]
- Jones CU, Hunt D, McGowan DG, et al. Radiotherapy and short-term androgen deprivation for localized prostate cancer. New England Journal of Medicine 2011; 365(2):107-118.[PubMed Abstract]
- Pisansky TM, Hunt D, Gomella LG, et al. Duration of androgen suppression before radiotherapy for localized prostate cancer: radiation therapy oncology group randomized clinical trial 9910. Journal of Clinical Oncology 2015; 33(4):332-339.[PubMed Abstract]
- Nabid A, Carrier N, Martin AG, et al. Duration of androgen deprivation therapy in high-risk prostate cancer: A randomized phase III trial. European Urology 2018; 74(4):432-441. [PubMed Abstract]
- Shipley WU, Seiferheld W, Lukka HR, et al. Radiation with or without antiandrogen therapy in recurrent prostate cancer. New England Journal of Medicine 2017; 376(5):417-428. [PubMed Abstract]
- Oudard S, Latorzeff I, Caty A, et al. Effect of adding docetaxel to androgen-deprivation therapy in patients with high-risk prostate cancer with rising prostate-specific antigen levels after primary local therapy: A randomized clinical trial. JAMA Oncology 2019 Jan 31. doi: 10.1001/jamaoncol.2018.6607 [PubMed Abstract]
- Morris MJ, Rumble RB, Milowsky MI. Optimizing anticancer therapy in metastatic non-castrate prostate cancer: ASCO Clinical Practice Guideline Summary. Journal of Oncology Practice 2018; 14(5):319-322. doi: 10.1200/JOP.18.00075
- Fizazi K, Tran N, Fein L, et al. Abiraterone plus prednisone in metastatic, castration-sensitive prostate cancer. New England Journal of Medicine 2017; 377(4):352-360.[PubMed Abstract]
- James ND, de Bono JS, Spears MR, et al. Abiraterone for prostate cancer not previously treated with hormone therapy. New England Journal of Medicine 2017; 377(4):338-351.[PubMed Abstract]
- Scher HI, Fizazi K, Saad F, et al. Increased survival with enzalutamide in prostate cancer after chemotherapy. New England Journal of Medicine 2012; 367(13):1187-1197.[PubMed Abstract]
- Beer TM, Armstrong AJ, Rathkopf DE, et al. Enzalutamide in metastatic prostate cancer before chemotherapy. New England Journal of Medicine 2014; First published online: June 1, 2014. doi: 10.1056/NEJMoa1405095
- Kyriakopoulos CE, Chen YH, Carducci MA, et al. Chemohormonal therapy in metastatic hormone-sensitive prostate cancer: Long-term survival analysis of the randomized phase III E3805 CHAARTED trial. Journal of Clinical Oncology 2018; 36(11):1080-1087.[PubMed Abstract]
- Studer UE, Whelan P, Albrecht W, et al. Immediate or deferred androgen deprivation for patients with prostate cancer not suitable for local treatment with curative intent: European Organisation for Research and Treatment of Cancer (EORTC) Trial 30891. Journal of Clinical Oncology 2006; 24(12):1868-1876.[PubMed Abstract]
- Devlin HL, Mudryj M. Progression of prostate cancer: Multiple pathways to androgen independence. Cancer Letters 2009; 274(2):177-186.[PubMed Abstract]
- Schröder FH. Progress in understanding androgen-independent prostate cancer (AIPC): A review of potential endocrine-mediated mechanisms. European Urology 2008; 53(6):1129-1137.[PubMed Abstract]
- Bluemn EG, Coleman IM, Lucas JM, et al. Androgen receptor pathway-independent prostate cancer is sustained through FGF signaling. Cancer Cell 2017; 32(4):474-489.[PubMed Abstract]
- Zelefsky MJ, Eastham JA, Sartor AO. Castration-Resistant Prostate Cancer. In: Vincent T. DeVita J, Lawrence TS, Rosenberg SA, eds. DeVita, Hellman, and Rosenberg’s Cancer: Principles & Practice of Oncology, 9e. Philadelphia, PA: Lippincott Williams & Wilkins; 2011.
- Fizazi K, Scher HI, Molina A, et al. Abiraterone acetate for treatment of metastatic castration-resistant prostate. Lancet Oncology 2012; 13(10):983-992.[PubMed Abstract]
- Ryan CJ, Smith MR, Fizazi K, et al. Abiraterone acetate plus prednisone versus placebo plus prednisone in chemotherapy-naive men with metastatic castration-resistant prostate cancer (COU-AA-302): Final overall survival analysis of a randomised, double-blind, placebo-controlled phase 3 study. Lancet Oncology 2015; First published online: January 16, 2015. doi: 10.1016/S1470-2045(14)71205-7.
- Smith MR, Saad F, Chowdhury S, et al. Apalutamide treatment and metastasis-free survival in prostate cancer. New England Journal of Medicine 2018; 378(15):1408-1418.[PubMed Abstract]
- Hussain M, Fizazi K, Saad F, et al. Enzalutamide in men with nonmetastatic, castration-resistant prostate cancer. New England Journal of Medicine 2018; 378(26):2465-2474.[PubMed Abstract]
- Fizazi K, Shore N, Tammela TL, et al. Darolutamide in nonmetastatic, castration-resistant prostate cancer. New England Journal of Medicine 2019; Feb 14. doi: 10.1056/NEJMoa1815671. [PubMed Abstract]
- Crook JM, O’Callaghan CJ, Duncan G, et al. Intermittent androgen suppression for rising PSA level after radiotherapy. New England Journal of Medicine 2012; 367(10):895-903. [PubMed Abstract]
- Hussain M, Tangen CM, Berry DL, et al. Intermittent versus continuous androgen deprivation in prostate cancer. New England Journal of Medicine 2013; 368(14):1314-1325. [PubMed Abstract]
- Magnan S, Zarychanski R, Pilote L, et al. Intermittent vs continuous androgen deprivation therapy for prostate cancer: A systematic review and meta-analysis. JAMA Oncology 2015; 1(9):1261-1269. [PubMed Abstract]
- National Comprehensive Cancer Network. NCCN Guidelines for Patients®: Prostate Cancer. Version 1.2013 ed. Fort Washington, Pa. : National Comprehensive Cancer Network; 2013: http://www.nccn.org/patients/guidelines/prostate/index.html#1/z
- Sanda MG, Dunn RL, Michalski J, et al. Quality of life and satisfaction with outcome among prostate-cancer survivors. New England Journal of Medicine 2008; 358(12):1250-1261. [PubMed Abstract]
- Michaelson MD, Kaufman DS, Lee H, et al. Randomized controlled trial of annual zoledronic acid to prevent gonadotropin-releasing hormone agonist-induced bone loss in men with prostate cancer. Journal of Clinical Oncology 2007; 25(9):1038-1042.[PubMed Abstract]
- Greenspan SL, Nelson JB, Trump DL, Resnick NM. Effect of once-weekly oral alendronate on bone loss in men receiving androgen deprivation therapy for prostate cancer: A randomized trial. Annals of Internal Medicine 2007; 146(6):416-424. [PubMed Abstract]
- Smith MR, Egerdie B, Hernández Toriz N, et al. Denosumab in men receiving androgen-deprivation therapy for prostate cancer. New England Journal of Medicine2009; 361(8):745-755. [PubMed Abstract]
- Sparreboom A, Cox MC, Acharya MR, Figg WD. Herbal remedies in the United States: Potential adverse interactions with anticancer agents. Journal of Clinical Oncology2004; 22(12):2489-2503. [PubMed Abstract]
- Galvão DA, Taaffe DR, Spry N, Newton RU. Exercise can prevent and even reverse adverse effects of androgen suppression treatment in men with prostate cancer.Prostate Cancer and Prostatic Diseases 2007; 10(4):340-346. [PubMed Abstract]
関連情報
原文掲載日
【免責事項】
当サイトの記事は情報提供を目的として掲載しています。
翻訳内容や治療を特定の人に推奨または保証するものではありません。
ボランティア翻訳ならびに自動翻訳による誤訳により発生した結果について一切責任はとれません。
ご自身の疾患に適用されるかどうかは必ず主治医にご相談ください。
前立腺がんに関連する記事
高リスク前立腺がんの治療ー放射線か手術か
2025年9月24日
今回報告された研究ではその疑問を明...
【AACR2025】 オラパリブ+ペムブロリズマブ併用は、分子マッチングによる臓器横断的試験で有望な結果
2025年7月18日
【ASCO2025】年次総会注目すべき追加研究・LBA ②
2025年7月18日
エンザルタミドは進行前立腺がんの生存期間を延長
2025年6月17日





